
Erstellung von Referenzstandard-Testsätzen
Potenzielle Partikelquellen oder Defekte, die bei der Produktion von Arzneimitteln auftreten können, ermittelt jedes Unternehmen individuell durch eine intern durchgeführte Riskioanalyse. Bei der Produktion von Parenteralia können unter anderem die folgenden Defekte und Partikel entstehen:
-
- Containerfehler
z. B. Kratzer, Risse, Verschmutzungen, Stopfen- und Bördelkappendefekte
- Containerfehler
- Partikel in der Lösung sowie anhaftende Partikel am Container oder am Containerverschluss
z. B. Glas, Fasern, Gummi, Kunststoffe, Metalle
- Abweichende Produktcharakteristika
z. B. Verfärbungen, Trübungen, inkorrekte Füllvolumina
Auf der Basis der vom Kunden durchgeführten Risikoanalyse erstellt M.A.S… für jeden Kunden individuell definierte Testsätze.

Referenzstandards für flüssige Arzneimittel

Referenzstandards für flüssige Arzneimittel/ Parenteralia werden durch eine Präparation direkt am Container hergestellt. Hierfür können bereits befüllte Container von unseren Kunden verwendet oder die Abfüllung von M.A.S… übernommen werden. Referenzstandards können für folgende Containerformen erstellt werden:
-
- Vials
- Fertigspritzen
- Ampullen
- Zylinderampullen
- Infusionsbeutel
- BFS Container
Vermessene Partikel können auch auf Objektträgern mit Vertiefungen zur Verfügung gestellt werden, sofern die Präparation auf Kundenseite durchgeführt werden soll. Die Partikel werden mit einer detaillierten Dokumentation geliefert.
Erstellung von Referenzstandards mit Partikeln
Für die Erstellung von Partikelmustern können vom Kunden bereit gestellte Materialien oder Partikel aus dem umfangreichen Partikelbibliothek von M.A.S… verwendet werden.
Partikel aus Glas, Metall oder Kunststoff können ab einer Größe von 50µm hergestellt werden. Die Präparation von Fasern und Haaren wird, aufgrund der Dicke, erst ab einer Faserlänge von 100µm empfohlen.
Jedes Partikelmuster wird mit einer detaillierten Dokumentation bereitgestellt. Sämtliche Daten werden mithilfe eines Stereomikroskops und des modifizierten Bildanalyseprogramms AnalySIS digital berechnet und gespeichert. Die Dokumentation besteht aus einem Zertifikat, einer umfangreichen tabellarischen Aufstellung der berechneten Partikeldaten (unter anderem Größe, Umfang, Formfaktor, Durchmesser), sowie aus einer Mikroskopieaufnahme jedes präparierten Partikels.
Erstellung von Referenzstandards mit Defekten
Container, die bei der optischen Kontrolle aufgrund von Defekten aussortiert werden, können unter anderem folgende Mängel aufweisen:
-
- Containerdefekte:
Kratzer, Risse, Verschmutzungen, Absplitterungen
- Verschlussdefekte:
Falscher Verschluss, beschädigter Stopfen, unvollständige Verbördelung - Produktcharakteristika:
Verfärbung, Trübung, inkorrektes Füllvolumen
- Containerdefekte:
Die verschiedenen Defekte werden im M.A.S… Labor realitätsnah simuliert und detailliert dokumentiert. Containerdefekte wie Risse oder Absplitterungen werden nach den Vorgaben des Kunden (z. B. in verschiedenen Größenklassen, an unterschiedlichen Positionen des Containers) präpariert und computergestützt vermessen. Abweichende Produktcharakteristika wie z. B. Trübungen oder Verfärbungen werden nach Vorgaben des Kunden hergestellt.

Erstellung von lyophilisierten Referenzstandards
Gefriergetrocknete Arzneimittel sind aufgrund der geringen Stabilität des Lyokuchens oft nicht für die Erstellung von Referenzstandards geeignet.
Für die Erstellung von lyophilisierten Referenzstandards hat M.A.S… deshalb eine eigene Lyo-Stabilisator-Mischung entwickelt. Aufgrund der hohen Stabilität des Lyokuchens ist dieser für die Qualitätskontrolle von gefriergetrockneten Produkten gut geeignet. Nach Kundenwunsch kann der Lyokuchen gegebenenfalls farblich angepasst werden. Die Stabilisatormischung wird in die vom Kunden bereit gestellten Container abgefüllt und mit den angeforderten Defekten und Partikeln versehen. Die Muster werden anschließend in unseren Gefriertrocknern der Firma Christ lyophilisiert.

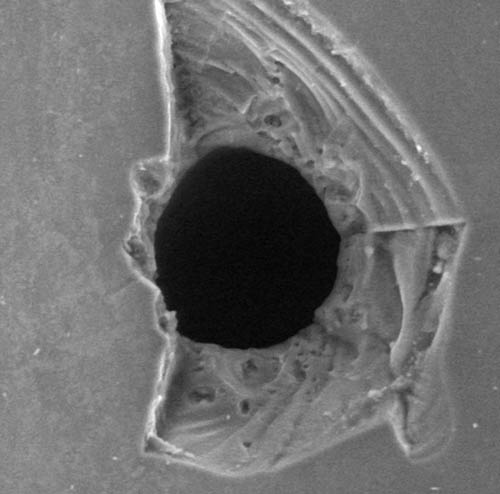
Erstellung von Referenzstandards mit Pinholes
Die Dichtigkeitsprüfung von Containern (Container Closure Integrity Test) ist ein wichtiger Aspekt der Qualitätskontrolle in der pharmazeutischen Industrie. M.A.S… bietet hierfür die Erstellung von lasergedrillten Löchern (Pinholes) in Containern an. Pinholes können ab einer Größe von 5-10µm in Ampullen, Fertigspritzen, Karpullen und Röhrenglasvials erstellt werden. Die Pinholes können für verschiedene Prüfmethoden wie Immersionstests mit einem Färbemittel oder Hochspannungs- Leckage Tests verwendet werden.
Mediafill
Ein kritischer Prozess bei der Herstellung von Parenteralia ist deren sterile bzw. aseptische Abfüllung. Zur Validierung der Produktionslinie müssen sogenannte Media Fills durchlaufen werden. Hierzu wird eine Nährlösung anstelle des Produkts abgefüllt und nach einer definierten Inkubationszeit, einer eingehenden mikrobiologischen und optischen Kontrolle unterzogen.
Für Schulungszwecke erstellt M.A.S… auf der Basis der Nährlösung die gewünschten Trübungsmuster. Die mikrobiologische Kontamination kann mit Hilfe einer Standardlösung simuliert werden. Der Trübungsgrad der Mediafill-Proben wird nach Kundenwunsch eingestellt.

